为什么细胞活力测量很重要?
在近十年来,细胞疗法已成为治疗各种癌症疾病的主要方法之一。最终目标是检索免疫细胞(即T细胞,NK细胞)并遗传修饰它们以识别和消除患者的癌细胞。因此,准确测量细胞活力至关重要,否则可能导致经过治疗治疗患者(1-3)的患者中的低效率或诱导不希望的自身免疫反应。

美国大会还认识到21中细胞计数和细胞活力测量标准的重要性英石细胞和基因治疗的世纪治愈法案。2014年3月31日,美国食品和药物管理局(FDA)举办了一场题为“细胞疗法和再生药物产品标准开发的协同努力”的研讨会。随着美国国家标准与技术研究所(NIST)和其他利益相关方的加入,细胞计数和活力测量保证被确定为提高细胞治疗产品质量的重要标准(4)。
什么是台盼蓝?
台盼蓝是一种偶氮染料(m.w. 960 Da),一个多世纪以来一直被用于细胞活力的测量(5,6)。它可以集中在膜受损的死亡或濒死细胞中,但在膜不透的活细胞中被排除(7,8)。尽管锥虫蓝存在许多问题,如蛋白质聚集(9-11),有限的计数时间窗口(12),以及存活率低于80%时的测量不准确(13-15),但它仍然是活性染料的选择。
自2012年以来,我们发表了三篇详细介绍台盼蓝染色细胞计数问题的文章。第一篇发表的论文证明台班蓝亮场计数可以过多计数活外周血单个核细胞(16)。第二篇发表的定量研究表明,台台蓝可以将Jurkat细胞和原代小鼠脾细胞的死亡细胞转化成昏暗和弥散的形状,当细胞活力低于80%时,就会导致对活力的高估(15)。我们在最近发表的第三篇文章(17)中进一步研究了漫反射物体的形成。
台盼蓝染色后形成的这些模糊而弥散的物体是什么?
传统上,这些漫对象是很难看到在显微镜图像,使研究人员能够下计数死细胞和高估的可行性。与此相反,在Cellometer仪器光学部件能够清楚地图像朦胧在Jurkat漫射物体,小鼠脾细胞,和人PBMC。
在这项工作中,我们记录台盼蓝和细胞之间的相互作用的实时,证明细胞转变为漫对象的破裂。与使用该染色膜受损的死细胞的核荧光生存能力染料(碘化丙啶,PI),我们证明,这些漫射物体包含一个核。
最后,我们假设渗透压的增加导致死亡或死亡的免疫细胞破裂。通过改变缓冲液浓度和量化台台蓝染色细胞的大小和颜色变化来验证这一假设。
记录在这些实验中的视觉和定量证据表明,台盼蓝可以诱导这些漫射物体的形成,并最终导致过度估计的活力,这可能对下游细胞治疗测定产生显着影响。
初步肉眼观察台台蓝染色Jurkat细胞中昏暗和弥漫性物体
我们表明,在Cellometer Autot4捕获的明亮场图像中,用台盼蓝显示出2天历史的Jurkat细胞样品(储存在冰箱中2天2天)。

使用Cellometer自动T4截取的图1明场细胞图像。细胞用台盼蓝(左),并用PI(右)染色的细胞染色。
- 明亮、圆润、丰满的细胞为未被台盼蓝染色的活细胞。
- 是蓝色,黑暗和紧凑的细胞死亡,并通过台盼蓝染色。
- 大,暗淡和漫反射物是可能死亡的或染色的细胞,受台球蓝的影响。
此外,当在冰箱存储期间在不同时间点收集细胞时,我们观察到染色Jurkat细胞,小鼠脾细胞和人PBMC的漫反射物和人PBMC的增加(图2)。有趣的是,用PI染色的Jurkat细胞没有表现出相同的形态变化。

图2。Jurkat细胞、小鼠脾细胞和人外周血细胞染色
台盼蓝破裂死亡或濒死的Jurkat细胞
为了视频捕获台盼蓝的染色过程中,我们建立与CHT4细胞计数室中的阶段,以允许台盼蓝的缓慢扩散到腔室中(图3)。首先,室充满2日龄的Jurkat细胞的20μL。接着,将空气释放口之一是录音在具有透明胶带以防止液体移动。最后,台盼蓝的10微升的液滴吸取其他空气释放口。然后将Cellometer AutoT4用于捕捉图像和视频在对细胞计数室(视频1)的具体位置。
在第一个捕捉到的视频中,我们观察到台班蓝从下到上扩散到整个屏幕,在与台班蓝相互作用后,它在45秒内将死亡或垂死的细胞变成了大的扩散物体。下一个视频显示台台蓝从上到下扩散,细胞在~2秒内破裂并逐渐消失。在视频中,一些死细胞被渲染成黑暗和紧凑,而另一些则变暗和弥漫。
台盼蓝染色暗淡和漫射物体实际上细胞
为了证明昏暗和弥散的物体实际上是死细胞,我们用碘化丙啶(PI)染色细胞的细胞核。如果不存在PI荧光,则表示物体中没有DNA物质。我们用台台蓝和PI同时染色2天的Jurkat细胞,发现PI荧光信号与台台蓝阳性物重叠,说明弥漫性台台蓝染色物实际上是死亡细胞(图4a)。合并亮场和红色荧光图像显示PI阳性细胞保持致密外观,不呈现台盼蓝阳性细胞弥漫性形态(图4b),提示PI不具有与台盼蓝相同的形态效应。
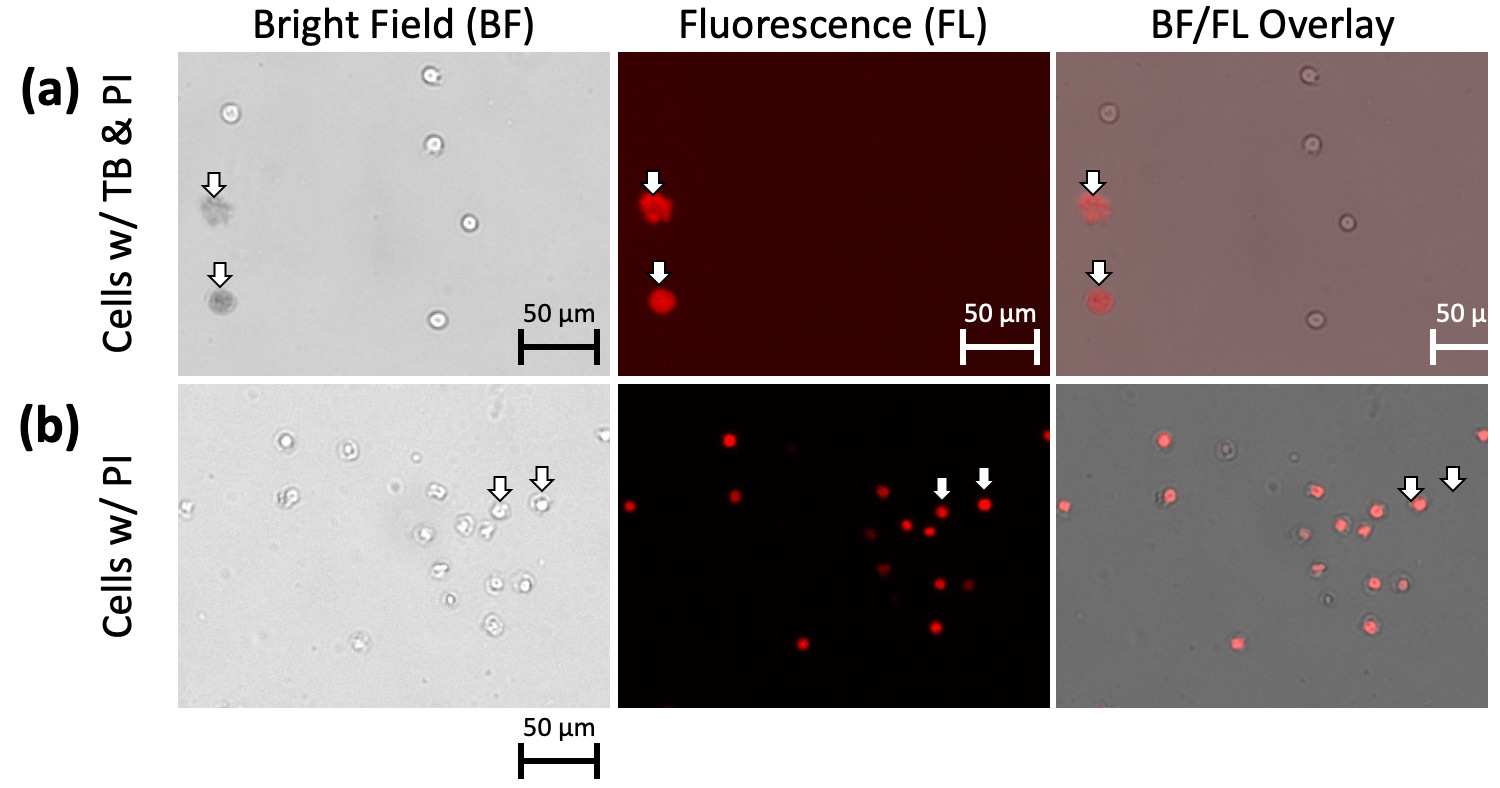
图4。2天大的Jurkat细胞,台台蓝和PI
台盼蓝基于细胞破裂是由高渗透压和水流入引起
我们认为细胞破裂可能是由于较高的渗透压引起水的快速流入。不同PBS浓度对台盼蓝染色有明显影响(图5a)。将2天龄Jurkat细胞用0.25 ~ 10倍不同浓度的PBS重悬。0.25X PBS导致破裂细胞的数量和大小增加。在1X ~ 6X PBS中培养的细胞表现出类似的弥漫性形态,但随着黑暗程度的增加。8X和10X的PBS形成沉淀,可能是由于高盐浓度(18)。结果显示,破裂细胞的数量和大小都有所减少,而在黑暗中明显增加。PBS浓度依赖性光强测量显示,随着PBS浓度的增加,光强降低(图5b),这强烈表明台班蓝染色时,由于水内流导致细胞破裂。

图5.以不同浓度的PBS重新悬浮2天旧的Jurkat细胞
具有台盼蓝的细胞染色可以迅速增加细胞质蛋白(8,19)上带负电残留物的数量,这吸引了更高的带电离子如钠,导致高水分流入并破裂已经脆弱的细胞膜和细胞骨架(3,20-22)。
热杀死的死细胞不会被台盼蓝破坏
有趣的是,台盼蓝染色热灭活的Jurkat细胞没有表现出扩散的形态(15,23)。在视频中,热灭活细胞台盼蓝染色(视频2),可通过膜蛋白在沸腾时变性引起的,导致细胞膜硬化,能承受台盼蓝水涌入(没有破裂24,25)。台盼蓝似乎进入死细胞和增加黑暗而不破裂的膜,其中,单元尺寸仅比1微米增加较少。最终的静止图像显示没有膨胀台盼蓝染色的细胞(图6)的。
结束言论
自2017年两种嵌合抗原受体(CAR) T细胞疗法获FDA批准以来(26),细胞疗法因其高疗效而成为重要的癌症治疗手段。准确的细胞计数和活力(FDA推荐的细胞治疗产品活力大于70%(27))是必需的,以确保适当的剂量,并最大限度地降低自身免疫反应的风险(1,2)。我们推测,将大量死亡细胞转移给患者可能会产生潜在的副作用,如细胞因子释放综合征(28)。
对于生物学家来说,选择最准确的细胞计数方法是适合目的的,特别是对于轿车T等细胞治疗产品,其中细胞数和活力显着影响治疗效果。在尖塔蓝染色期间破裂的细胞在明场成像下难以看出,并且可以在估计上估计,导致细胞活力的过度估计。我们建议使用荧光核染色方法,这些方法可以更准确地估计细胞活力(15,16,23,29-31)。
- 陈志强,陈志强。自体免疫与死亡细胞的清除。单元2010,140(5):619 - 630。
- 细胞死亡引起的炎症反应。病理年报2008;3:99-126。
- 张Y,Chen X,Gueydan C,Han J.血浆膜在编程细胞死亡期间发生变化。2018年细胞研究; 28:9-21。
- Arcidiacono JA, Bauer SR, Kaplan DS, Allocca CM, Sarkar S, Lin-Gibson S, FDA和NIST在支持再生药物产品创新和转化的标准开发活动上的合作。Cytotherapy 20:779 2018; 784年。
- Piccinini F, Tesei A, Arienti C, Bevilacqua A.二维和三维细胞培养的细胞计数和活力评估:台盼蓝分析的预期可靠性。生物工程学报2017;19(8):1-12。
- 台盼蓝染料进入蜡样芽孢杆菌致孔毒素HlyII培养的活细胞。《公共科学图书馆•综合》2011;6 (9):e22876。
- 钟德敏,金jh,金jk。MTT法和台盼蓝法对HepG2细胞辐射诱导细胞活力测定的评价。国际放射学杂志2015;13(4):1-6。
- 温赖特M.染料,锥虫病和DNA:历史和严格审查。Biotechnic和2010年组织化学; 85(6):341-354。
- Beaudoin AR,Kahkonen D.耳蛋白蓝对胎鼠血清蛋白质的影响。解剖记录1963; 147(3):387-395。
- 黑L, Berenbaum MC.影响细胞活性染料排除试验的因素。《实验细胞研究》1964;35:9-13。
- 高宏伟,赵建峰。台盼蓝与蛋白质的相互作用及应用。中国化学学报2003;50:329-334。
- 郭国平,杨志强,赖泰勇,陈国平,彭长平。台盼蓝对人视网膜色素上皮细胞活性及基因表达的影响。英国眼科杂志2004;88(12):1590-1594。
- Mascotti K,McCullough J,Burger SR。HPC活力测量:台盼蓝与吖啶橙和碘化丙锭。输血2000; 40(6):693-696。
- 坦能JR。台盼蓝技术细胞活力测定评价。移植1964; 2(6):686-694。
- Chan Ll-Y,Kuksin D,Laverty DJ,Saldi S,秋J.使用自动图像细胞术进行锥虫蓝和荧光的活力检测方法的形态学观察和分析。Cytotech。2014; DOI 10.1007 / S10616-014-9704-5。
- Chan Lly,Laverty DJ,Smith T,Nejad P,Hei H,Gandhi R,Kuksin D,血压使用图像细胞术进行外周血单核细胞浓度的精确测量,消除RBC诱导的计数误差。轴颈免疫学方法2013; 388(1-2):25-32。
- 关键词:台盼蓝,破裂,死亡细胞,形态学效应《公共科学图书馆•综合》2020;15 (1):e0227950。
- 关键词:台盼蓝,镍,排斥试验,灵敏度2+或公司2+盐。Cytotechnology 2000; 32:93-95。
- 刘志强,王志强,王志强,等。离子粒径和电荷对渗透性能的影响。acta physica sinica(物理学报)2012;32(4):457 - 461。
- Bursch W, Hochegger K, Török L, Marian B, Ellinger A, Hermann RS.程序性细胞死亡的自噬和凋亡类型表现出细胞骨架丝的不同命运。细胞科学学报2000;113:1189-1198。
- 科斯塔版,Rodrigues的EB,迪布E,盘赫FM,富拉尼BA,O.Magalhães的Ĵ,马亚男,迈耶CH,米兰达广告,法拉ME。活体染料和光源为Chromovitrectomy:渗透压,pH和分光光度法的比较评价。调查眼科和视觉科学2009; 50(1):385-391。
- 洛迪什H,伯克A,Zipursky SL。15.8节渗透,水通道,以及细胞体积的调节。分子细胞生物学。第四版。纽约:W. H. Freeman;2000年。
- 陈LL,威尔金森AR,天堂BD,基于图像来N.快速术就荧光染色活力方法的比较。杂志2012荧光; 22(5):1301至11年。
- 朔夫JC,PadanilamĴ,福尔摩斯WH,Ezzell RM,李RC,Tompkins的RG,Yarmush ML,在超生理温度细胞膜渗透性变化的调色剂M.动力学。生物物理杂志1995; 68:2608年至2614年。
- 麦基BM, Miles CA, Parsons SE, Seymour DA。用差示扫描量热法检测大肠杆菌全细胞和细胞组分的热变性。
- Yip A, Webster RM。嵌合抗原受体T细胞疗法市场。《自然评论》2018;17:161-162。
- 美国 - 卫生和人类服务,食品 - 药物管理,生物制剂中心 - 评估 - 和研究。FDA审稿人和赞助商的指导 - 化学,制造和控制(CMC)的内容和审查人体细胞治疗研究新药物应用(INDS)2008。中国体育彩票欧洲杯
- 长谷川K,Hosen的N.嵌合抗原受体的T细胞疗法的多发性骨髓瘤。炎症和再生2019; 39(10):1-5。
- Altman SA,Randers L,Rao G.哺乳动物细胞活力测定的台盼蓝染料排斥和荧光测定的比较。生物技术进展1993; 9:671-674。
- 引用本文:王志强,王志强,王志强,等。脐带血低温保存对脐带血存活率的影响。输血2010;(4):820 - 830。
- chen LL-Y, McCulley KJ, Kessel SL.使用图像细胞计数的单、双和多染色方法评估细胞活力。分子生物学方法。体积1601;2017.p 27-41。









留下你的评论